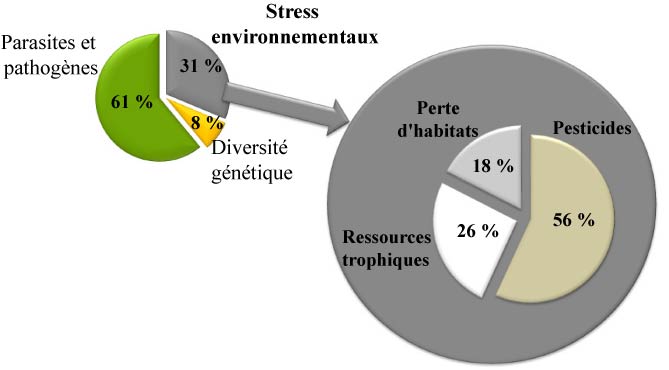
Espèce mutualiste [1] et polylectique [2], l’abeille domestique est impliquée dans le processus de pollinisation de nombreuses plantes à fleurs sauvages et cultivées. En contrepartie, elle profite de la floraison de ces plantes pour l’acquisition de ressources polliniques et nectarifères [3]. Elle interagit avec une multitude de composantes paysagères et d’espèces floristiques [4]. Pourtant, on constate depuis une vingtaine d’années une forte diminution des populations d’abeilles domestiques et sauvages [5]. Celle-ci reste encore inexpliquée sur bien des aspects. L’ampleur ainsi que le nombre de pays touchés par ce phénomène inquiètent [5]. Outre les difficultés concernant l’alimentation et le poids économique du service rendu par la pollinisation [6], c’est un large pan du fonctionnement général des écosystèmes qui semble fragilisé. Les études les plus récentes ne permettent que d’augurer une synergie entre plusieurs causes [7]. Parmi elles, l’organisation du paysage (composition et structure) n’est pas immédiatement suspectée comme élément central et n’apparaît pas comme facteur aussi déterminant que le Varroa destructor [8], les maladies parasitaires ou de manière plus prégnante, l’utilisation des pesticides et fongicides en agriculture (graines enrobées, pratiques d’épandage, etc.). En effet, comme l’indique l’étude bibliographique et statistique de Requier (2013), réalisée à partir de 1538 publications parues entre 1975 et 2013, les causes de dépérissement et ou de mortalité des colonies d’abeilles domestiques les plus analysées portent à hauteur de 61 % sur les effets liés aux parasites et pathogènes (Fig.1). 31 % seulement interrogent les répercussions liées aux stress environnementaux. Parmi elles seules 44 % étudient les impacts liés à la structure et à la composition du paysage (pertes d’habitats et de ressources alimentaires). Moins encore questionnent le rôle de la composante ligneuse [9] (bois, bosquets, haies, arbres isolés, etc.), rare élément pérenne ou stable du paysage, pour l’apport de ressources alimentaires aux colonies.
Raréfaction et homogénéisation des ressources alimentaires en contexte paysager agricole
Malgré le manque prégnant d’études, nous savons qu’abeilles domestiques et sauvages dépendent entièrement des ressources floristiques disponibles au sein des paysages agricoles pour permettre leur développement physiologique et leur survie [10]. Or, progressivement, cette dépendance s’est vue fragilisée. Les importantes transformations paysagères orchestrées depuis plus de 50 ans (Fig. 2), via la simplification des assolements, l’abattage des haies (le remembrement), la réduction du temps de rotation entre les cultures, l’intensification dans la gestion des prairies, l’usage de variétés hybrides, ou encore de produits phytosanitaires, ont engendré un appauvrissement de l’agrobiodiversité faunistique et floristique [11], ainsi qu’une raréfaction spatio-temporelle et qualitative des ressources nectarifères et pollinifères disponibles [12 et 13].

Ce déclin est particulièrement frappant pour les adventices [14a] du fait de l’usage d’herbicides [15]. Bien que la modernisation de l’agriculture ait favorisé l’essor de certaines plantes stratégiques pour les pollinisateurs, tels que le colza ou le tournesol, beaucoup d’autres ont régressé dont la phacélie, le sainfoin, les féveroles, etc [13]. La généralisation de certaines cultures a destiné une importante partie des surfaces agricoles à de la monoculture [16] et créée une dépendance étroite des colonies d’abeilles domestiques à celles-ci. Toutefois, la sélection de certaines variétés de colza et de tournesol pour leurs propriétés oléifères [17] au détriment de leur intérêt nectarifère les rend aujourd’hui moins intéressantes du point de vue des pollinisateurs [13]. De plus vouées à l’usage massif de produits phytosanitaires, elles présentent un risque majeur en termes de contamination [18].
L’émergence de périodes de disette [21]
Au-delà de l’homogénéisation et de la raréfaction des ressources alimentaires, la transformation des paysages agricoles de plaine et de coteaux a fait apparaître deux périodes de disette [20 et 21]. Ces disettes ont été initialement observées en contexte de céréaliculture intensive en région Poitou-Charentes (Zone Atelier Plaine & Val de Sèvre [22]) à l’aide du dispositif d’observation « ECOBEE » mis en place entre 2008 et 2012 avec 250 colonies observées sur 50 sites. Les mêmes tendances ont été relevées dans le département du Gers via l’étude que nous avons menée entre 2009 et 2012 sur 42 colonies et six sites variant selon un gradient de présence de ligneux. ; ces derniers étant situés en contexte de grandes cultures et polyculture / élevage [24] (Fig. 3).
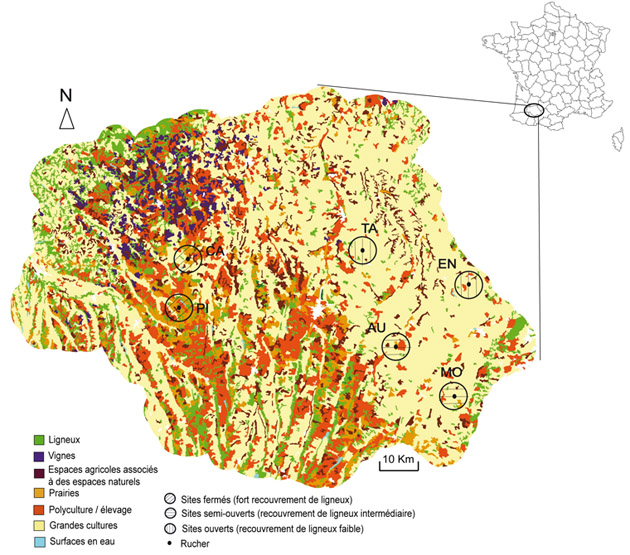
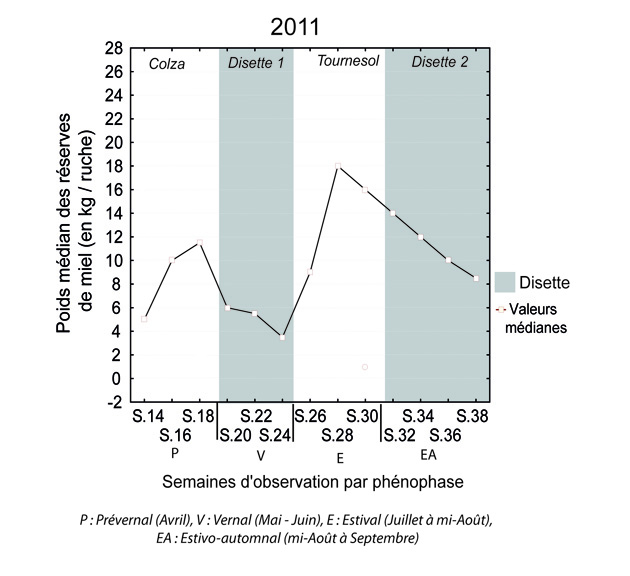
Dans ce type de paysage, les résultats obtenus indiquent que le manque de ressources alimentaires intervient à deux reprises, après la floraison du colza puis après la floraison du tournesol [20 et 24] soit respectivement aux mois de juin et d’août. À l’échelle des colonies, les répercussions sont immédiates. Elles se traduisent notamment par une forte réduction des réserves de miel (Fig.4) et de pollen ainsi que par une chute des quantités de pelotes de pollen ramenées à la ruche [24]. Une trop forte pénurie présente le risque d’altérer le développement physiologique de la colonie voire en cas de prolongation, d’engendrer des comportements cannibales [25].
À l’heure actuelle, en dehors de la floraison des grandes cultures, la présence de ressources alimentaires est essentiellement reléguée aux espaces semi-naturels pérennes et principalement à la composante ligneuse : arbres isolés, haies, bois, bosquets, lisières, forêts [24].
Le rôle de la composante ligneuse dans l’apport de ressources alimentaires
L’étude menée dans le département du Gers nous a permis – via l’analyse du profil floristique des miels collectés tout au long de la saison 2011 sur 42 colonies – d’appréhender le rôle des différents « compartiments » paysagers (cultures, ligneux, prairies, espaces verts) dans l’apport des ressources alimentaires. Les résultats montrent que les surfaces cultivées et ligneuses sont les plus mobilisées tout au long de la saison. Les prairies interviennent en troisième position du fait de l’intensification des modes de gestion associés. Enfin, la faible présence de surfaces jardinées réduit nettement leur attrait [24].
Pour ce qui est des cultures, colza et tournesol sont les deux principales ressources mobilisées aussi bien pour le nectar que pour le pollen [24]. Le maïs est également très recherché mais uniquement pour le pollen [4]. Colza et tournesol fleurissent respectivement aux mois d’avril et de juillet/août ce qui explique la forte mobilisation des surfaces cultivées en période prévernale et estivale (Fig. 4). Les plantes adventices des cultures telles que la mercuriale, le coquelicot, l’ambroisie ou le chénopode sont également très recherchées, principalement pour le pollen, d’où un attrait dominant pour les surfaces cultivées en période estivo-automnale (mi-Août à fin Septembre), (Fig. 5).
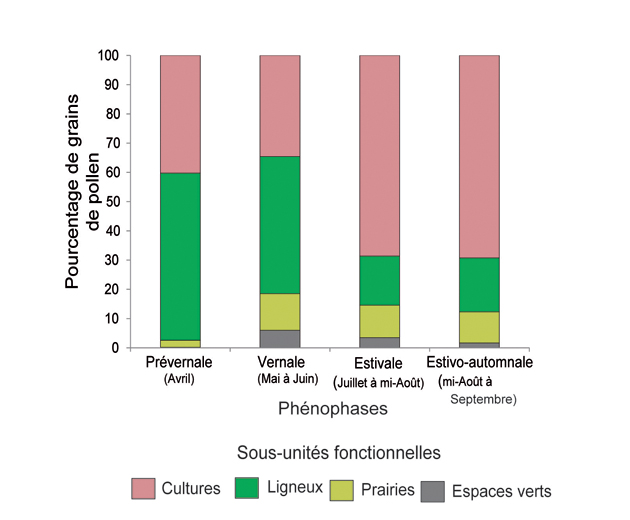
Les ressources issues de la composante ligneuse semblent d’avantage recherchées en début de saison, ou période prévernale (Avril) et en première partie de la période vernale (Mai), (Fig. 5). Les taxons associés aux milieux humides (ripisylves) tels que le saule contribuent le plus fortement au démarrage du couvain [24]. La période vernale permet la récolte de nectar et de pollen de fruitiers (prunelliers, aubépine, pommiers, etc.; Fig. 5). La floraison du colza en période prévernale n’amoindrit pas de manière significative l’intérêt porté à la composante ligneuse, y compris lorsque celle-ci dispose d’un faible taux de recouvrement [24]. Cette tendance témoigne d’un réel besoin et attrait des colonies pour les ressources ligneuses. En fin de période vernale (Juin) ou première période de disette les ronces très présentes dans les haies, les lisières de bois, de bosquets ainsi que les friches sont les principales ressources ligneuses disponibles [24]. Elles permettent d’amoindrir les effets liés au manque important de nectar et de pollen disponible. Durant les périodes de disette, lorsqu’elle est maintenue et non fauchée, la strate herbacée associée à la composante ligneuse offre une ressource floristique diversifiée. On y trouve fréquemment du lotier, du trèfle du millepertuis et bien d’autres espèces [24].
Enfin, la moindre mobilisation des ligneux aux périodes estivale (Juillet à mi-Août) et estivo-automnale s’explique par la fin de la floraison de nombreuses espèces associées à cette composante, ainsi que par un intérêt majeur porté au tournesol puis à la mercuriale et au maïs. Le léger regain observé en période estivo-automnale est essentiellement le fait d’une très forte mobilisation du lierre pour le nectar comme pour le pollen [26].
Conclusion
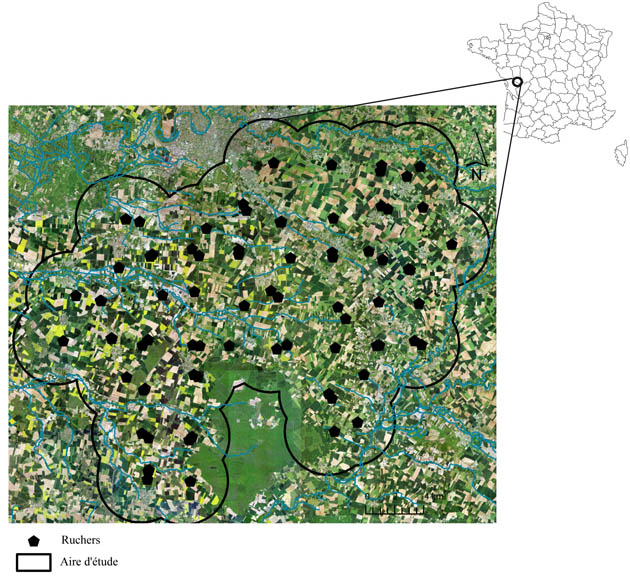
Des travaux récents de plus en plus nombreux font état du rôle stratégique joué par la composante arborée ainsi que la strate herbacée associée en terme de limitation de l’érosion des sols, de système de phytorémédiation [27], de haies brise vent, de zones refuges non impactées par les traitements phytosanitaires et d’habitats pour les auxiliaires [28] de culture [29]. D’après notre étude, cette composante s’avère également stratégique pour l’apport de ressources pérennes aux colonies. Elle offre une alternative importante aux cultures et joue un rôle compensatoire en période de disette. Les premières tendances obtenues permettent d’apporter des éléments de compréhension quant à l’intérêt des différentes composantes paysagères pour l’abeille domestique voire plus largement pour les pollinisateurs. Ces tendances invitent également les politiques publiques et les professionnels (chercheurs, paysagistes, etc.) à re-questionner l’aménagement de l’espace agricole de la parcelle au paysage afin d’y concilier les exigences liées au maintien des filières apicole, agricole et aux besoins des pollinisateurs. L’approche géographique proposée via le prisme paysager ne cherche pas à minimiser la diversité des causes à l’origine des pertes et ou mortalités subies par les abeilles domestiques (pesticides, varroa, frelon, maladies…), mais plutôt à enclencher une réflexion sur les enjeux liés à la qualité alimentaire des paysages. Ces derniers pouvant être appréhendés comme vecteurs favorables pour l’amélioration de la résilience [30] des colonies. Toutefois établir des liens entre organisation des paysages et santé des colonies nécessite avant tout une confirmation des premières tendances observées, à plus large échelle spatio-temporelle. Pour ce faire, le projet RESBEE [31] vise à associer les résultats préliminaires observés dans le département du Gers sur les six sites présentés en amont, avec les données collectées sur 50 sites en région Poitou-Charentes via le dispositif ECOBEE (Fig.6). La finalité étant de comprendre dans quelles mesures la composante ligneuse des paysages agricoles de type céréaliculture intensive à polyculture / élevage, et sa structure spatiale, favorisent la résilience des colonies d’abeilles domestiques. Existe-t-il des seuils de présence de ligneux ou des formes d’aménagement du paysage plus adaptées à un maintien durable des populations d’abeilles ?
[1] Association de deux animaux d’espèces différentes qui retirent des bénéfices réciproques de cette union, sans vivre aux dépens l’un de l’autre (Rey A., Rey-Debove, J. ; 1986).
[2] Espèces qui butinent plusieurs genres de plantes à fleurs de manière non spécialisée
[3] Pouvreau, 2004
[4] Odoux et al., 2012
[5] Potts et al., 2010
[6] Gallai et al., 2009
[7] Van Engelsdorp, et Meixner, 2010
[8] Acarien parasite de l’abeille adulte, des larves et des nymphes
[9] Désigne l’ensemble des éléments arborés, arborescents, arbustifs, lianescents et la strate herbacée associée, dans le paysage.
[10] Brodschneider et Crailsheim, 2010
[11] Burel et al., 2008
[12] Guillerme et al, 2015
[13] Davaine, 2012
[14] Plante présente dans un endroit telle une parcelle de culture, sans y avoir été intentionnellement implantée.
[15] Janson et al., 2004
[16] Schaller, 2012
[17] Qui produit de l’huile (Rey A., Rey-Debove, J. ; 1986).
[18] Henry et al., 2012
[19] Raréfaction accrue des ressources alimentaires disponibles dans le paysage à certaines périodes de l’année.
[20] Requier, 2013
[21] Naug, 2009
[22] www.za.plainevalsevre.cnrs.fr
[23] Odoux et al., 2014
[24] Rhoné, 2015 ;
[25] Schmickl et Crailsheim, 2001
[26] Garbuzov et Ratnieks, 2014
[27] Dépollution des sols, de l’eau et ou de l’air par le biais des plantes.£[28] Être vivant qui détruit les ravageurs des cultures ou atténue leurs effets
[29] Dupraz et Liagre, 2008
[30] Capacité d’un organisme vivant ou d’un système quelconque à retrouver son état initial après avoir subi un choc ou une perturbation.
[31] http://w3.geode.univ-tlse2.fr/postdocs/rhone.php
Brodschneider, R., Crailsheim, K. (2010). Nutrition and health in honey bees. Apidologie, 41, 278–294.
Burel, F. (coord.), Garnier, E. (coord.), Amiaud, B., Aulagnier, S., Butet, A., Chauvel, B., Carré, G., Cortet, J., Couvet, D., Joly, P., Lescourret, F., Plantureux, S., Sarthou, JP., Steinberg, C., Tichit, M., Vaissière, B., Tuinen, D. Van, Villenave, C. (2008). Les effets de l’agriculture sur la biodiversité. Chapitre 1. In Sabbagh, C. (dir.). Agriculture et Biodiversité : des synergies à valoriser. Rapport de l’expertise scientifique collective réalisée par l’Inra à la demande du Ministère de l’Agriculture et de la Pêche (MAP) et du Ministère de l’Écologie, de l’Énergie, du Développement Durable et de l’Aménagement du Territoire (MEEDDAT). Paris : ESCo, INRA, 175 p.
Davaine, JB. (2012). Recent changes in melliferous resources in the french agricultural landscape : the case of field crops and fodder production. Bulletin Académique Vétérinaire, 165 (4), 293-306.
Dupraz, C., et Liagre, F. (2008). Agroforesterie. Des arbres et des cultures. Paris : France Agricole, 413 p.
Gallai, N., Salles, JM., Settele, J., Vaissière, BE. (2009). Economic valuation of the vulnerability of world africulture confronted with pollinator decline. Ecological Economics, 68, 810-821.
Garbuzov, M., Ratnieks, FLW. (2014). Ivy: an underappreciated key resource to flower visiting insects in autumn. Insect Conservation and Diversity, 7, 91-102.
Henry, M., Béguin, M., Requier, F., Rollin, O., Odoux, JF., Aupinel, P., Aptel, J., Tchamitchian, S., Decourtye, A. (2012) A common pesticide decreases foraging success and survival in honey bees. Science, 336:348-350. Doi: 10.1126/science.1215039.
Janson, JP., Fontanges, A. de, Deneufbourg, F., Jouly, L. (2004). Nuisibilité des adventices en production de semences fourragères : cas du vulpin dans le ray-grass anglais. In : XIIème Colloque International sur la Biologie des Mauvaises Herbes, Dijon , France, 81-88.
Naug, D. (2009). Nutritional stress due to habitat loss may explain recent honeybee colony collapses. Biological Conservation, 142, 2369-2372.
Odoux, JF., Feuillet, D., Aupinel, P., Loublier, Y., Tasei, JN., Mateescu, C. (2012). Territorial biodiversiy and consequences on physico-chemical characteristics of pollen collected by honey bee colonies. Apidologie, 43, p. 561-575. Doi : 10.1007/s13592-012-0125-1.
Odoux, JF., Aupinel, P., Gateff, S., Requier, F., Henry, M., Bretagnolle, V. (2014). ECOBEE: a tool for longterm honey bee colony monitoring at the landscape scale in West European intensive agoecosystems. Journal of Apicultural Research, 53 (1), 57-66.
Potts, SG., Roberts, SPM., Dean, R., Marris, G., Brown, MA., Jones, R., Neumann, P., Settele, J. (2010). Declines of managed honey bees and beekeepers in Europe. Journal of Apicultural Research, 49 (1), 15- 22.
Pouvreau, A. (2004). Les insectes pollinisateurs. Paris: Delachaux & Niestlé, 189 p. (La bibliothèque du naturaliste).
Requier, F. (2013). Dynamique spatiotemporelle des ressources florales et et éclogie de l’abeille domestique en usage agricole intensif. Thèse de doctorat : Biologie de l’Environnement, des Populations, Écologie ; Université de Poitiers, 202 p.
Rey A., Rey-Debove J. (1986). Le petit robert 1, dictionnaire alphabétique et analogique de la langue française. Paris : Dictionnaires LE ROBERT, 2171 p.
Rhoné F., Laffly, D., Maire, E., Briane, G., Guillerme, S., Britten, V. (2015). Evolution phénologique des ressources nectarifères et pollinifères mobilisées par l’abeille domestique Apis mellifera l. au de structures paysagères agricoles du Gers (32, France) : le rôle de la composante ligneuse ? In Maire, E. (coord), Laffly, D. (coord). Abeille / paysages. Quae : Paris, 270 p.
Rhoné, F. (2015). L’abeille à travers champs. Quelles interactions entre Apis mellifera L. et le paysage agricole (Gers, 32) ? Le rôle des structures paysagères ligneuses dans l’apport de ressources trophiques et leurs répercussions sur les traits d’histoire de vie des colonies. Thèse de doctorat : Géographie et aménagement ; Université Toulouse II, Jean-Jaurès, 543 p.
Schaller, N. (2012). La diversification des assolements en France : intérêts, freins et enjeux. Analyse, 51, p. 1-4.
Schmickl, T., Crailsheim, K. (2001). Cannibalism and early capping: strategies of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A, 187, 541–547.
Van Engelsdorp, D., Meixner, MD. (2010). A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. Journal of Invertebrate Pathology, 103, S80- S95.